El modelo de Bohr es una descripción clara, pero también imperfecta de que conocemos como la estructura del átomo.
El modelo de Bohr, como su nombre indica fue presentado por el físico danés Niels Bohr en el año 1913, y supuso un paso muy importante en el camino hacia la comprensión y estudio de los átomos y su estructura y comportamiento.
Por aquel entonces, el científico danés Niels Bohr, sabía que el anterior modelo del átomo de Rutherford no era exacto. Por ese motivo, y con un increíble afán de descubrimiento, Bohr utilizó los hallazgos de Max Planck y Albert Einstein junto con su comprensión de los espectros de emisión y absorción de los elementos químicos para desarrollar su modelo del átomo, y lo que hoy en día conocemos como el Modelo Atómico de Bohr.
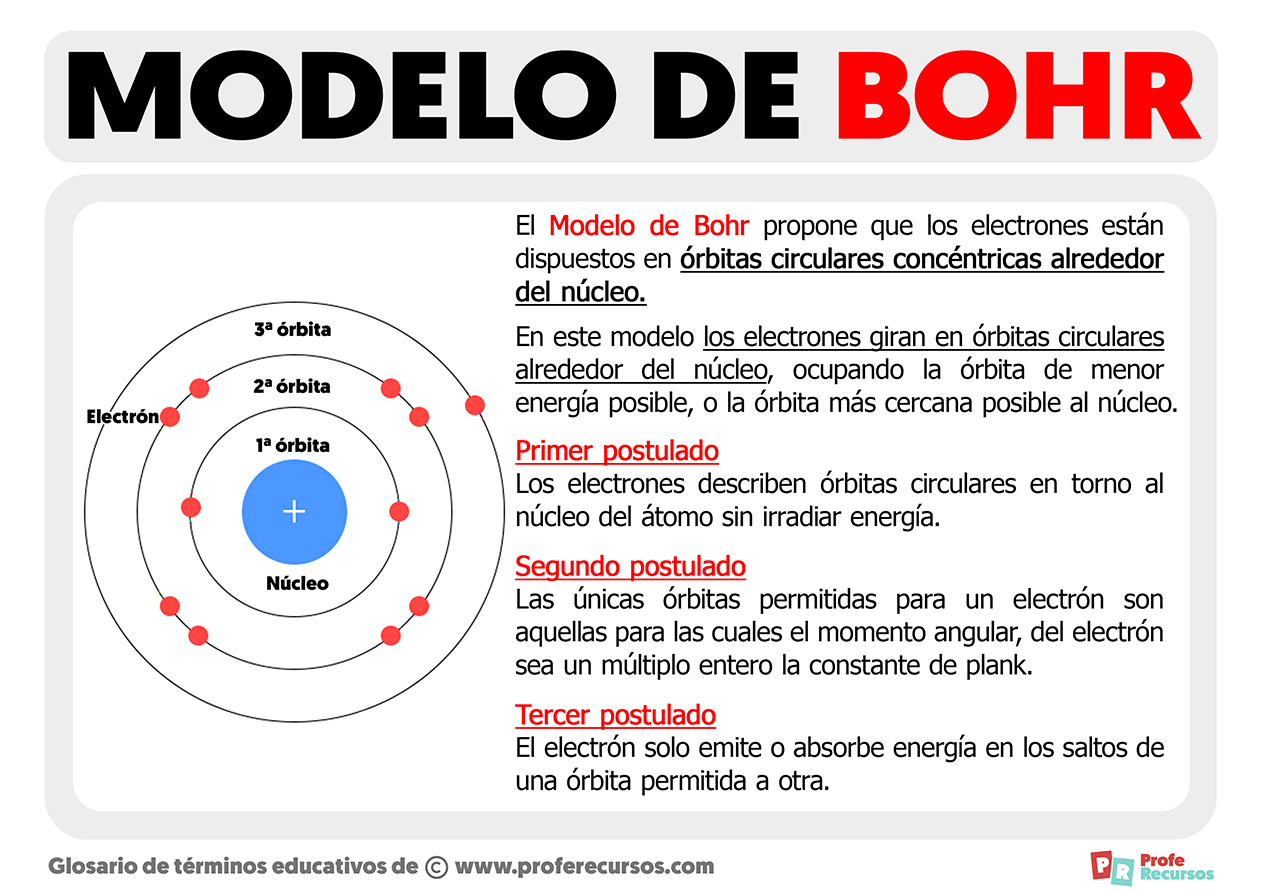
Bohr supuso que las ideas de Rutherford sobre los electrones que orbitaban alrededor del núcleo eran correctas. Propuso que los electrones existían en distintos niveles de energía, o capas, alrededor del núcleo y que cada capa tiene una cantidad diferente de energía. Bohr también llegó a la conclusión de que la energía de un electrón está cuantizada, esto quiere decir que un electrón puede estar en un nivel de energía u otro (también denominados órbitas de electrones), pero jamás se encuentra entre los diferentes niveles de energía.
Bohr planteó la hipótesis de que cuando un electrón está en la capa, no emite ni absorbe energía. Esto se llama el estado fundamental del electrón. Bohr continuó con sus postulados a través de la proposición que decía que un electrón podría moverse a un nivel de energía más alto, o capa, absorbiendo energía. Esto se llama el estado excitado del electrón. El electrón puede volver a su estado fundamental liberando la energía que absorbió. El proceso de emisión de luz ocurre cuando el electrón libera energía.



Deja tu comentario