Dentro del mundo de la química y los procesos físicos y biológicos, se da un determinado tipo de reacción química que es muy relevante en multitud de procesos, esta reacción, es la reacción de oxidación.
En este post, vamos a estudiar las características y peculiaridades de este tipo de reacción, además de sus aplicaciones. Acompañaremos la explicación con un ejemplo. Dicho esto, empezamos con la definición de oxidación.
¿Qué es una reacción de oxidación?
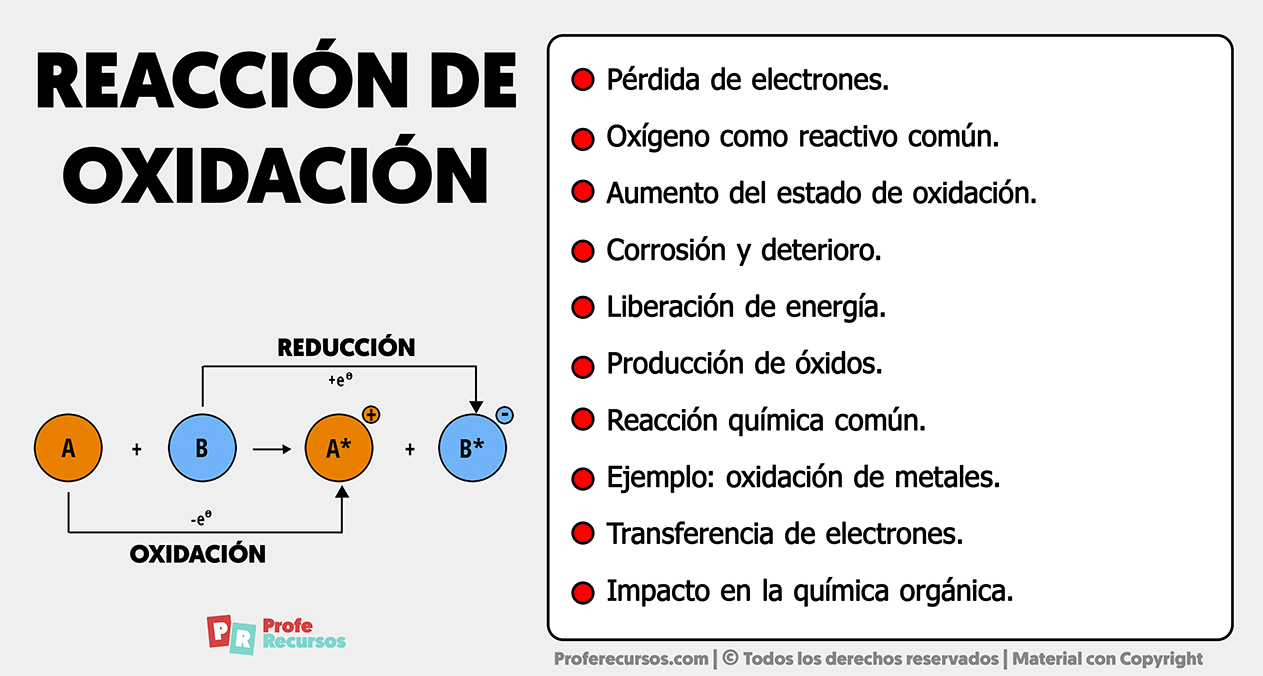
La reacción de oxidación es un proceso químico en el cual, una sustancia, cede electrones a otra, resultando en un aumento en el estado de oxidación de la primera sustancia y una reducción en la segunda.
Es muy importante en este tipo de reacciones, resaltar que implica la pérdida de electrones que, por lo general, se acompaña de la adición de oxígeno o la eliminación de hidrógeno.
Las reacciones de oxidación se dan en muchos procesos como en la combustión, la corrosión, e incluso dentro de nuestro metabolismo celular.
Características de la reacción de oxidación
- Pérdida de electrones: En una reacción de oxidación, una sustancia cede electrones a otra. Esta pérdida de electrones es la característica mas importante que define la oxidación.
- Oxígeno como reactivo común: El oxígeno es un reactivo común en muchas reacciones de oxidación. La adición de oxígeno a una sustancia es una indicación de que se está produciendo una reacción de oxidación.
- Aumento del estado de oxidación: La oxidación se caracteriza por un aumento en el estado de oxidación de la sustancia que pierde electrones. Esto se traduce en una disminución en la carga negativa de la sustancia.
- Corrosión y deterioro: Las reacciones de oxidación pueden causar corrosión y deterioro en materiales metálicos y otros objetos, lo que a menudo se observa como el envejecimiento y desgaste de superficies.
- Liberación de energía: Las reacciones de oxidación a menudo liberan energía en forma de calor y luz. (ver concepto de reacción exotérmica) Esto es evidente en procesos como la combustión, donde se desprende calor y se produce luz.
- Producción de óxidos: Las reacciones de oxidación frecuentemente resultan en la formación de óxidos, que son compuestos que contienen oxígeno. Los óxidos son productos comunes de la oxidación.
- Reacción química común: Las reacciones de oxidación son comunes y las podemos encontrar en una amplia variedad de aplicaciones, tanto en química, como en biología, metalurgia y algunas industrias importantes más.
- Ejemplo: oxidación de metales: Un ejemplo clásico de oxidación es la oxidación de metales, como el hierro (veremos este ejemplo más adelante), que se combina con el oxígeno del aire para formar óxido de hierro (corrosión).
- Impacto en la química orgánica: Las reacciones de oxidación también son importantes en la química orgánica, donde se utilizan para modificar y transformar compuestos orgánicos, a menudo para sintetizar productos químicos útiles.
Un ejemplo de reacción de oxidación
Un ejemplo muy común de reacción de oxidación, y que podemos ver con frecuencia, es la corrosión del hierro. Cuando el hierro entra en contacto con el oxígeno del aire y la humedad del ambiente, se produce una reacción química que lleva a la formación de óxido de hierro, comúnmente conocido como óxido de hierro (III) o herrumbre.
La ecuación química que utilizamos para representar esta reacción es:
4Fe + 3O2 + 6H2O → 4Fe(OH)3
En esta reacción, el hierro (Fe) pierde electrones y se oxida, formando con ello el óxido de hierro, mientras que el oxígeno (O2) se reduce.
La herrumbre, o también comunmente llamado óxido, es un ejemplo muy práctico y fácil de visualizar, de cómo las reacciones de oxidación pueden causar deterioro en materiales metálicos debido a la corrosión.
Bibliografia
- Dickerson, R. E. (1992). Principios de química. España: Reverté.
- Manuel Torres, E. d. (2004). Lo esencial sobre las reacciones químicas.. España: ANAYA EDUCACIÓN.



Deja tu comentario