Dentro del mundo de la química y los procesos físicos y biológicos, se da un determinado tipo de reacción química que es muy relevante en muchos procesos, esta reacción, es la reacción de reducción.
En este post, vamos a estudiar las características y peculiaridades de este tipo de reacción, además de sus aplicaciones. Acompañaremos la explicación con un ejemplo. Dicho esto, empezamos con la definición de reducción.
¿Qué es una reacción de reducción?
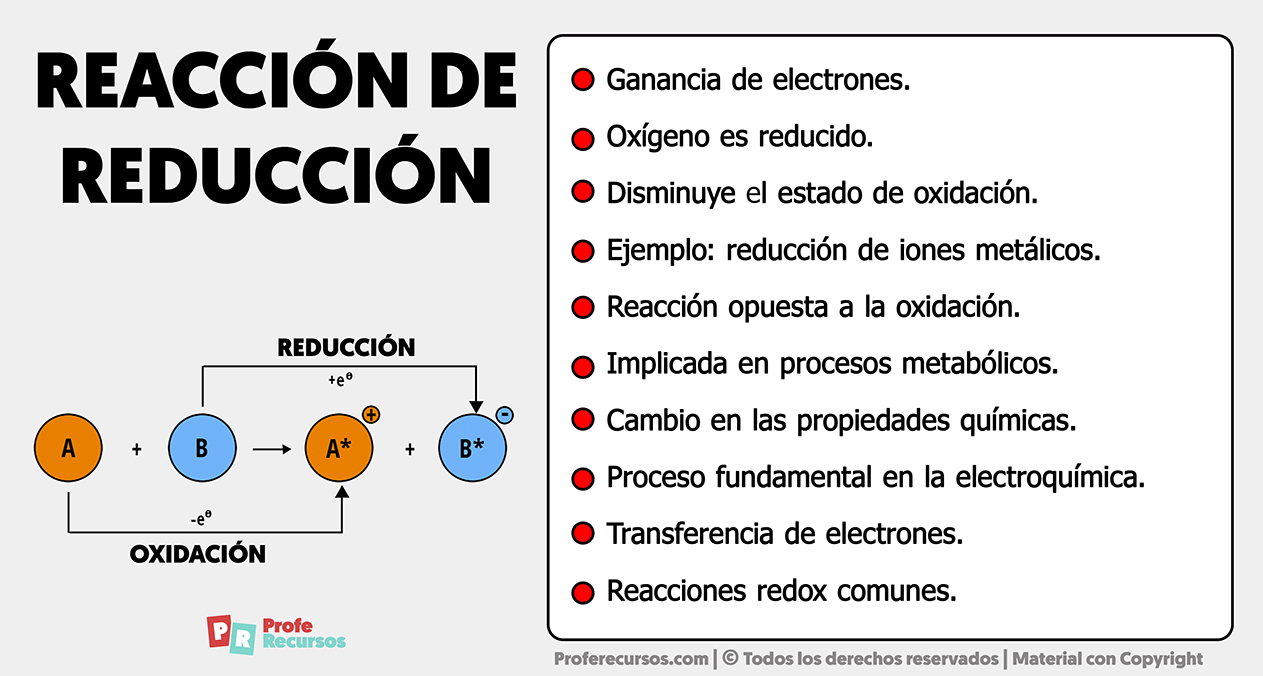
Una reacción de reducción implica la ganancia de electrones por parte de un átomo, molécula o ion. Durante este proceso, la sustancia reducida experimenta una disminución en su estado de oxidación.
Estas reacciones son fundamentales en los procesos redox, donde la reducción y la oxidación están interconectadas. Las reacciones de reducción son cruciales en sistemas biológicos, químicos e industriales, participando en la generación de energía, la síntesis de compuestos y diversos procesos electroquímicos.
Características de la reacción de reducción
- Ganancia de Electrones: En una reacción de reducción, la especie química gana electrones, lo que resulta en una disminución de su estado de oxidación.
- Proceso Redox: Las reacciones de reducción están intrínsecamente ligadas a reacciones de oxidación en procesos redox, donde una sustancia se reduce mientras otra se oxida.
- Interconexión con Oxidación: La reducción y la oxidación ocurren simultáneamente y están interrelacionadas, constituyendo un equilibrio redox.
- Relevancia Biológica e Industrial: Son fundamentales en sistemas biológicos, químicos e industriales, participando en la generación de energía, síntesis de compuestos y procesos electroquímicos.
- Cambios en el Estado de Oxidación: Las reacciones de reducción implican cambios en el estado de oxidación de los elementos, reflejando transformaciones químicas significativas.
Ejemplo de reacción de reducción
Un ejemplo clásico de una reacción de reducción es la reducción del oxígeno durante la respiración celular en organismos aeróbicos. La ecuación química general es:
C6H12O6 + 6O2 → 6CO2 + 6H2O
En esta reacción, la glucosa (C6H12O6) se oxida, liberando electrones que son aceptados por el oxígeno (O2), formando dióxido de carbono (CO2) y agua (H2O). La reducción del oxígeno es esencial para la producción de energía en las células.
Bibliografia
- Dickerson, R. E. (1992). Principios de química. España: Reverté.
- Manuel Torres, E. d. (2004). Lo esencial sobre las reacciones químicas.. España: ANAYA EDUCACIÓN.



Deja tu comentario